Agora que já estudamos o modelo ondulatório proposto por Maxwell, o qual afirma que a luz é uma onda eletromagnética e cujo modelo quântico seria composto por um conjunto de partículas chamadas fótons, nos interessa saber se, afinal, a luz é uma onda ou partícula.
A verdade é que não há uma resposta única para essa pergunta. O correto é dizer que depende do fenômeno, uma vez que a luz ora se comporta como onda, ora como partícula. Portanto, não podemos afirmar nada sobre o que a luz de fato é, mas sim, em como ela se comporta em determinados fenômenos.
Alguns fenômenos físicos como, por exemplo, a interferência e a difração da luz, são explicados pelo modelo ondulatório. Já o efeito fotoelétrico, para ser explicado corretamente, deve fazer uso do modelo quântico de fótons. Desse modo, ambos os modelos são importantes e complementares.
Chamamos de dualidade onda-partícula esse duplo comportamento da luz.
Vale ressaltar que tanto a luz quanto as demais radiações eletromagnéticas não exibem os dois comportamentos simultaneamente. Esse é o Princípio da Complementaridade proposto por Niels Bohr.

Átomo de Bohr
Em um átomo, os elétrons encontram-se em diferentes níveis de energia. Os elétrons dos níveis de mais baixa energia estão mais próximos do núcleo; já os que estão em níveis de mais alta energia, situam-se mais distantes do núcleo.
A figura abaixo apresenta um átomo cujos elétrons estão em diferentes níveis de energia. Para que o elétron do nível 1 passe para o nível 2, precisamos fornecer certa energia a ele, já que o núcleo exerce uma força de atração sobre esse elétron.
Desse modo, no nível 2, o elétron encontra-se em um nível de energia maior do que quando ocupava o nível 1.
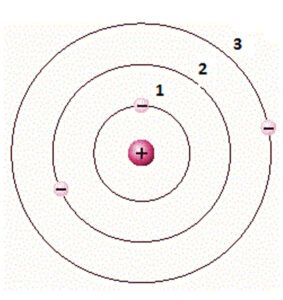
Modelo Atômico de Bohr
O átomo sempre foi estudado por meio de modelos propostos pelos cientistas. Cada modelo trouxe hipóteses baseadas em formulações teóricas e nos resultados experimentais obtidos pelos seus respectivos autores, permanecendo válido até que apresentasse falhas na explicação dos fenômenos. Caso isso ocorresse, os pesquisadores deveriam propor novos modelos ou adaptações às teorias já desenvolvidas.
Em 1911, Ernest Rutherford propôs um modelo que descrevia o átomo como um sistema planetário, no qual havia um núcleo central com carga positiva e elétrons em órbita ao redor. Embora importante, o modelo de Rutherford não explicava corretamente alguns fenômenos. De acordo com a teoria proposta por Maxwell, qualquer carga dotada de aceleração deveria emitir radiação eletromagnética, perdendo energia. Visto que um elétron do átomo de Rutherford descrevia uma órbita circular e, portanto, possuía aceleração centrípeta, ele deveria emitir permanentemente radiação, reduzindo seu nível de energia. Desse modo, deveria descrever uma trajetória espiralada até cair no núcleo, o que não ocorria, uma vez que as eletrosferas dos átomos são estáveis.
Além disso, há outro problema no modelo de Rutherford. Segundo Maxwell, a radiação emitida pelo elétron tem a mesma frequência do movimento. Assim, como a frequência do movimento do elétron deveria variar continuamente na ida até o núcleo, o elétron também deveria emitir continuamente radiação com frequência variável. Porém, a radiação emitida por um átomo deve ter apenas frequências de determinados valores, diferentemente da radiação térmica emitida por um corpo, a qual apresenta um espectro contínuo.
Em virtude dessas incoerências, Niels Bohr desenvolveu uma nova teoria, baseada em ideias quânticas. Bohr inferiu que, para a eletrosfera de um átomo ser mantida estável, os elétrons desse átomo deveriam assumir certos níveis de energia, chamados estados estacionários ou quânticos, cada um deles correspondendo a uma determinada energia. Ele postulou que, em um estado estacionário, o átomo não emitia radiação, de modo que sua eletrosfera se mantinha estável.
Gustav Hertz e James Franck, no ano seguinte, confirmaram a existência dos estados estacionários. O estado estacionário, cujos elétrons estão nos mais baixos níveis de energia, é chamado de estado fundamental; os demais estados permitidos são chamados de estados excitados. Isso quer dizer que são permitidos apenas o estado fundamental e os demais estados excitados — quaisquer outros estados são proibidos.
Considerando o caso particular do hidrogênio, que é constituído por apenas um elétron, os níveis de energia podem ser obtidos pela expressão abaixo:
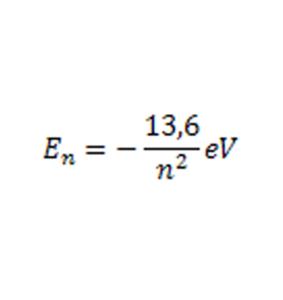
Onde o número quântico principal é simbolizado pela letra n (= 1, 2, 3…) e En é a energia correspondente a cada número quântico.
É importante ressaltar que n = 1 corresponde ao estado fundamental de energia. Além disso, os valores de energia são negativos, o que significa que o elétron precisa receber energia para chegar ao nível, deixando de interagir com o núcleo nesse momento, ou perdendo o vínculo com o átomo.
Bohr também postulou que todo átomo, ao passar de um estado estacionário para outro, emite ou absorve um quantum de energia exatamente igual à diferença entre as energias correspondentes a esses estados. Esse resultado não pode ser explicado pela teoria eletromagnética clássica, uma vez que, de acordo com ela, a frequência da radiação emitida está relacionada com a frequência do movimento do elétron. Hoje sabemos que isso não está correto, visto que a frequência da radiação emitida relaciona-se apenas com a diferença de energia entre os estados inicial e final.
Segundo Bohr, os elétrons descrevem trajetórias circulares ao redor de um núcleo positivo devido à força de atração dada pela Lei de Coulomb que, nesse caso, é a força centrípeta do movimento. Os raios dessas trajetórias só podem assumir certos valores bem determinados. Para o hidrogênio, por exemplo, os valores permitidos para os raios são dados pela expressão abaixo:

Onde:
n = número quântico (n = 1, 2, 3…);
rn = raio da órbita correspondente ao número quântico n;
r1 = raio correspondente ao estado fundamental de energia, dado por:
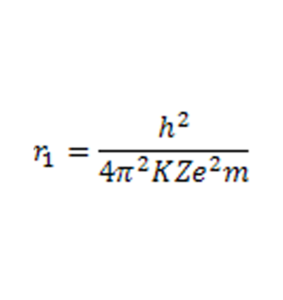
Onde:
h = constante de Planck (h = 6,63×10-34J s);
K = constante eletrostática do vácuo (K = 9×109 Nm²/C²);
Z = número atômico do elemento químico;
e = carga do elétron (K = 1,6×10-19 C);
m = massa do elétron (e = 9,1 x10-31 kg).

