Niels Henrik David Bohr (Copenhaga, 7 de outubro de 1885 — Copenhaga, 18 de novembro de 1962) foi um físico dinamarquês cujos trabalhos contribuíram decisivamente para a compreensão da estrutura atômica e da física quântica.
Bohr desenvolveu um modelo atômico no qual ele propôs que os níveis de energia dos elétrons são discretos e que os elétrons revolucionam em órbitas estáveis em torno do núcleo atômico, sendo capazes de “saltar” de um nível de energia (ou uma órbita) para outro. Apesar de o modelo atômico de Bohr ter sido suplantado por outros modelos, alguns de seus princípios fundamentais permanecem válidos. Ele concebeu o princípio da complementaridade: que objetos poderiam ser analisados separadamente com propriedades contraditórias, comportando-se como uma onda ou um fluxo de partículas. A noção de complementaridade dominou o pensamento de Bohr tanto na ciência quanto na filosofia.
Licenciou-se na sua cidade natal em 1911 e trabalhou com Joseph John Thomson e Ernest Rutherford na Inglaterra. Em 1913 conseguiu interpretar algumas das propriedades das séries espectrais do hidrogênio e a estrutura do sistema periódico dos elementos químicos. Formulou o princípio da correspondência e, em 1928, o da complementaridade. Estudou ainda o modelo nuclear da gota líquida e, antes da descoberta do plutónio, previu a propriedade da fissão nuclear, análoga à do urânio-235. Bohr recebeu o Nobel de Física em 1922 por “sua contribuição na investigação da estrutura dos átomos e da radiação emitida por eles”.
A sua teoria para a explicação do modelo atômico proposto por Rutherford em 1911, levando em conta a teoria quântica (formulada por Max Planck em 1900), não foi inicialmente levada a sério. Depois, no decorrer e depois da década de 1920, vários físicos ajudaram a criar o modelo existente hoje. Entre estes físicos podem ser citados, entre outros, Albert Einstein, Louis de Broglie, Erwin Schrödinger, Werner Heisenberg e Wolfgang Pauli.
Início de vida
Primeiros anos e educação
Bohr nasceu em Copenhague, Dinamarca, em 7 de outubro de 1885, o segundo dos três filhos de Christian Bohr, um professor de fisiologia na Universidade de Copenhague e descobridor do efeito de Bohr, e de Ellen Adler Bohr, descendente de uma rica família judia dinamarquesa, proeminente em bancos e em círculos parlamentares. Niels tinha uma irmã mais velha, Jenny, e um irmão mais novo, Harald. Jenny tornou-se uma professora, enquanto Harald tornou-se matemático e jogador de futebol, tendo jogado pela Seleção Dinamarquesa de Futebol nos Jogos Olímpicos de Verão de 1908, em Londres. Niels também era um amante do futebol, e os dois irmãos jogaram várias partidas pelo clube de futebol copenhaguense Akademisk Boldklub, com Niels na função de goleiro.

Bohr em sua juventude
Bohr foi educado na Escola Latina Gammelholm, tendo ingressado aos sete anos de idade. Em 1903, Bohr ingressou na Universidade de Copenhague como graduando de física. Ele foi ensinado por Christian Christiansen, o único professor de física da instituição à época; ele também estudou astronomia e matemática com Thorvald Thiele, e filosofia com Harald Høffding, que era amigo de seu pai.
Em 1905, ocorreu uma competição patrocinada pela Academia Real Dinamarquesa de Ciências e Letras para investigar um método de medição da tensão superficial de líquidos, proposta em 1879 por John William Strutt, o Lord Rayleigh. O desafio envolvia medir a frequência de oscilação do raio de um jato d’água. Bohr fez uma série de experimentos utilizando o laboratório de seu pai na Universidade; a instituição em si não possuía um laboratório de física. Para completar seus experimento, ele teve de fazer seus próprios instrumentos de vidro, fabricando tubos de teste com as seções transversais elípticas necessárias. Niels foi além da tarefa original, incorporando melhorias à teoria e ao método de Rayleigh ao considerar a viscosidade da água e ao trabalhar com amplitudes finitas, ao invés de apenas com aquelas de tamanho infinitesimal. Seu trabalho, enviado às vésperas do fim do prazo do concurso, venceu a competição. Ele mais tarde submeteu uma versão melhorada do artigo para a Royal Society em Londres, para publicação na revista da instituição, Philosophical Transactions of the Royal Society.
Harald foi o primeiro dos dois irmãos a concluir seu mestrado, obtendo-o na área de matemática em abril de 1909. Niels levou outros nove meses para obter seu mestrado com a teoria eletrônica dos metais, um tópico designado por seu orientador, Christiansen. Bohr elaborou o tema de seu mestrado para produzir sua tese de doutorado em filosofia, sendo esta muito mais abrangente que sua dissertação. Ele pesquisou a literatura sobre o assunto, assentando-se em um modelo postulado por Paul Drude e elaborado por Hendrik Lorentz, no qual os elétrons de um metal são considerados como possuindo um comportamento semelhante ao de um gás. Bohr estendeu o modelo de Lorentz, mas continuou incapaz de entender fenômenos como o efeito Hall, concluindo que a teoria eletrônica não poderia explicar completamente as propriedades magnéticas dos metais. A tese foi aceita em abril de 1911, e Bohr defendeu-a em 13 de maio; Harald havia recebido seu doutorado no ano anterior. A tese de Bohr foi inovadora, porém atraiu pouco interesse fora da Escandinávia por ter sido escrita em Dinamarquês, um requisito da Universidade de Copenhague à época. Em 1921, a física neerlandesa Hendrika Johanna van Leeuwen demonstraria, de forma independente, um teorema a partir da tese de Bohr, hoje conhecido como teorema de Bohr–van Leeuwen.
Família

Bohr e Margrethe Nørlund em seu casamento em 1910.
Em 1910, Bohr conheceu Margrethe Nørlund, a irmã do matemático Niels Erik Nørlund. Bohr renunciou sua filiação à Igreja da Dinamarca em 16 de abril de 1912, e ele e Margrethe casaram-se em uma cerimônia civil na prefeitura em Slagelse em 1 de agosto. Anos depois, seu irmão Harald também deixou à Igreja de forma similar antes de seu próprio casamento. Bohr e Margrethe tiveram seis filhos. O mais velho, Christian, morreu em um acidente de barco em 1934, e outro, Harald, morreu de meningite na infância.Aage Bohr tornou-se um físico de sucesso e, em 1975, foi laureado com o Prêmio Nobel de Física, como seu pai. Hans Bohr tornou-se um médico; Erik Bohr, um engenheiro de química; e Ernest, um advogado. Como seu tio Harald, Ernest Bohr foi um atleta olímpico, havendo jogado hóquei sobre a grama pela Dinamarca nos Jogos Olímpicos de Verão de 1948, realizados em Londres.
Início de carreira
Átomo de Bohr
Em setembro de 1911, Bohr, apoiado por uma sociedade da Fundação Carlsberg, viajou à Inglaterra. À época, era o local onde estava sendo feito a maior parte do trabalho teórico sobre a estrutura de átomos e moléculas. Lá, conheceu J. J. Thomson do Laboratório Cavendish e do Trinity College, Cambridge. Bohr assistiu a palestras sobre eletromagnetismo promovidas por James Jeans e Joseph Larmor, e realizou algumas pesquisas em raios catódicos, mas não conseguiu impressionar Thomson. Ele encontrou maior sucesso entre físicos mais jovens como o australiano William Lawrence Bragg, e o neozelandês Ernest Rutherford, cujo modelo de 1911 de um átomo com núcleo central pequeno desafiava o modelo proposto por Thomson em 1904. Bohr recebeu um convite de Rutherford para conduzir um trabalho de pós-doutorado Universidade Victória de Manchester, onde Bohr conheceu George de Hevesy e Charles Galton Darwin (o qual Bohr referia como sendo “o neto do verdadeiro Darwin”).
Bohr retornou à Dinamarca em julho de 1912 para seu casamento, e viajou pela Inglaterra e pela Escócia na sua lua de mel. Ao retornar, ele tornou-se um privatdocent na Universidade de Copenhague, dando palestras sobre termodinâmica. Martin Knudsen indicou o nome de Bohr a docente, sendo aprovado para o cargo em julho de 1913, e Bohr então começou a ensinar estudantes de medicina. Seus três artigos, que mais tarde ficariam conhecidos como “a trilogia”, foram publicados na Philosophical Magazine em julho, setembro e novembro daquele ano. Ele adaptou a estrutura nuclear do modelo de Rutherford à teoria quântica de Max Planck e então criou o seu próprio modelo do átomo.
Modelos planetários dos átomos não eram novos, mas o tratamento fornecido por Bohr era. Tomando como ponto de partida o artigo publicado por Darwin em 1912 sobre o papel dos elétrons na interação de partículas alfa com um núcleo, ele fez avanços na teoria de elétrons viajando em órbitas em torno do núcleo atômico, com as propriedades químicas de cada elemento sendo em grande parte determinadas pelo número de elétrons nas órbitas mais externas de seus átomos. Ele introduziu a ideia de que um elétron poderia “descer” de uma órbita de maior energia para uma de menor energia, emitindo um quantum de energia discreta durante o processo. Esse raciocínio tornou-se a base do que eventualmente veio a ser conhecido como a antiga teoria quântica.
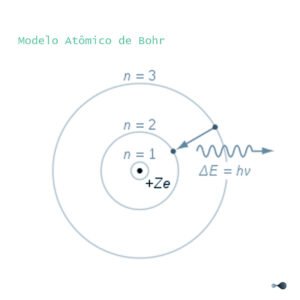
O modelo de Bohr do átomo de hidrogênio. Um elétron negativamente carregado, confinado a um orbital atômico, orbita um núcleo pequeno e carregado positivamente; um salto quântico entre órbitas é acompanhado pela emissão ou pela absorção de uma quantidade de radiação eletromagnética.

A evolução dos modelos atômicos durante o século XX: Thomson, Rutherford, Bohr, Heisenberg/Schrödinger
Em 1885, Johann Balmer descreveu o que ficou conhecido como a série de Balmer, uma lista das linhas espectrais do átomo de hidrogênio. Ele percebeu que os quatro comprimentos de onda λ em que essas linhas se encontravam (todas na região visível do espectro) obedeciam a seguinte fórmula:
{\displaystyle {\frac {1}{\lambda }}=R\left({\frac {1}{2^{2}}}-{\frac {1}{n^{2}}}\right)\quad {\text{para}}\ n=3,4,5,6}
em que R é a constante de Rydberg, medida experimentalmente. A fórmula de Balmer foi corroborada pela descoberta de novas linhas espectrais, correspondentes a valores maiores de n; entretanto, por trinta anos, ninguém conseguiu explicar por que ela funcionava. No primeiro artigo de sua trilogia, Bohr foi capaz de derivá-la de seu modelo, explicitando a dependência da constante de Rydberg de outras constantes fundamentais:
{\displaystyle R={\frac {m_{e}e^{4}}{8\epsilon _{0}^{2}h^{3}c}}}
em que me é a massa do elétron, e e é a sua carga; ε0 é a permissividade do vácuo, h a constante de Planck, e c a velocidade da luz. Além disso, o modelo de Bohr explicava a generalização da fórmula de Balmer em que o termo 1/22 é substituído por 1/m2, com m um inteiro menor que n.
A primeira limitação do modelo foi a série de Pickering, composta por linhas que não eram compatíveis com a fórmula de Balmer. Quando confrontado sobre isso por Alfred Fowler, Bohr respondeu que elas eram causadas pelo hélio ionizado, isto é, átomos de hélio com apenas um elétron. O modelo de Bohr pôde ser adaptado para íons desse tipo. Muitos físicos mais velhos, como Thomson, Rayleigh e Hendrik Lorentz não gostaram da trilogia, mas a geração mais jovem, incluindo Rutherford, David Hilbert, Albert Einstein, Enrico Fermi, Max Born e Arnold Sommerfeld perceberam-na como um grande avanço. A aceitação da trilogia foi completamente devida à sua capacidade de explicar fenômenos que bloqueavam outros modelos e de prever resultados que foram verificados em seguida por experimentos. Hoje, o modelo de Bohr para o átomo tornou-se ultrapassado, mas ainda é o modelo mais bem conhecido do átomo, aparecendo frequentemente em livros-texto de física e química do ensino secundário.
Bohr não gostava de ensinar estudantes de medicina. Ele decidiu retornar a Manchester, onde Rutherford lhe ofereceu um trabalho como leitor no lugar de Darwin, cujo mandato havia expirado. Bohr aceitou. Ele tirou licença da Universidade de Copenhague, começando por uma viagem de feriado a Tirol com seu irmão Harald e sua tia Hanna Adler. Nessa viagem, ele visitou a Universidade de Göttingen e a Universidade de Munique, onde conheceu Sommerfeld e conduziu seminários sobre sua trilogia. Enquanto estavam em Tirol, a Primeira Guerra Mundial eclodiu, dificultando enormemente a viagem de volta para a Dinamarca e a viagem subsequente de Bohr com Margrethe à Inglaterra, onde ele chegou em outubro de 1914. Eles ficaram até julho de 1916, quando ele já havia sido nomeado Presidente de Física Teórica da Universidade de Copenhague, uma posição criada especialmente para ele. Concomitantemente, sua documentação de licença expirou, então ele ainda tinha que dar aulas de física a estudantes de medicina. Novos professores foram formalmente introduzidos pelo Rei Cristiano X, que expressou seu prazer em conhecer um jogador de futebol tão famoso.
Instituto de Física
Em abril de 1917, Bohr começou uma campanha para estabelecer um Instituto de Física Teórica. Ele ganhou o apoio do governo dinamarquês e da Fundação Carlsberg, e contribuições significativas também foram feitas pela indústria e por doadores privados, muitos deles judeus. A legislação para o estabelecimento do Instituto foi aprovada em novembro de 1918. Hoje conhecido como o Instituto Niels Bohr, a instituição foi inaugurada em 3 de março de 1921, com Bohr como diretor. Sua família se mudou para um apartamento de primeiro piso. O instituto de Bohr serviu como um ponto focal para pesquisadores de mecânica quântica e assuntos relacionados entre os anos 1920 e 1930, período no qual a maioria dos físicos mais famosos do mundo passaram algum tempo em sua companhia. Entre os primeiros colaboradores estão Hans Kramers dos Países Baixos, Oskar Klein da Suécia, George de Hevesy da Hungria, Wojciech Rubinowicz da Polônia e Svein Rosseland da Noruega. Bohr tornou-se amplamente apreciado como seu anfitrião e colega eminente. Klein e Rosseland produziram a primeira publicação do Instituto antes mesmo de ele ser inaugurado.

Prédio do Instituto Niels Bohr, da Universidade de Copenhague.
O modelo de Bohr funcionava bem para o hidrogênio, mas não era capaz de descrever elementos mais complexos. Em 1919, Bohr já estava se afastando da ideia de que elétrons orbitavam o núcleo e desenvolveu uma heurística para descrevê-los. Os elementos de terras raras colocavam um problema particular de classificação para os químicos, por eles serem quimicamente semelhantes. Um avanço importante ocorreu em 1924 com a descoberta por Wolfgang Pauli de seu princípio de exclusão, que fornecia uma base teórica firme para os modelos de Bohr. Bohr foi então capaz de afirmar que o então desconhecido elemento de número atômico 72 não era um elemento de terras raras, mas sim um elemento com propriedades químicas semelhantes às do zircônio. Ele foi imediatamente desafiado pelo químico francês Georges Urbain, que afirmava ter descoberto um elemento de terras raras de número atômico 72, que ele chamava de “céltio”. No Instituto em Copenhague, Dirk Coster e George de Hevesy aceitaram o desafio de mostrar que Bohr estava certo, e não Urbain. Começar com uma ideia clara das propriedades químicas do elemento desconhecido simplificou em muito o processo de busca. Eles analisaram amostras do Museu de Mineralogia de Copenhague a procura de um elemento similar a zircônio e logo o encontraram. O elemento, que eles denominaram háfnio (Hafnia sendo o nome latino para Copenhague), acabou se mostrando mais comum que ouro.
Em 1922, Bohr foi laureado com o Prêmio Nobel de Física “pelos seus serviços na investigação da estrutura de átomos e da radiação que emana dele”. O prêmio, portanto, reconhecia tanto a sua trilogia quanto seu trabalho pioneiro no campo emergente da mecânica quântica. Para sua palestra do Nobel, Bohr mostrou à sua audiência uma compilação ampla do que era então conhecido sobre a estrutura do átomo, incluindo o princípio da correspondência, que ele havia formulado. Tal princípio afirmava que o comportamento de sistemas descritos pela teoria quântica reproduz a física clássica no limite de grandes números quânticos.
A descoberta do espalhamento da luz por partículas carregadas por Arthur Holly Compton em 1923 convenceu a maioria dos físicos que a luz era composta por fótons, e que energia e momento linear eram conservados em colisões entre elétrons e fótons. Em 1924, Bohr, Kramers e John C. Slater, um físico norte-americano que trabalhava no Instituto em Copenhague, propuseram o que ficou conhecido como a teoria Bohr–Kramers–Slater; tais ideias eram mais qualitativas do que uma teoria física em si. A teoria BKS tornou-se a última tentativa de entender a interação entre a matéria e a radiação eletromagnética utilizando a antiga teoria quântica, na qual fenômenos quânticos eram compreendidos através da imposição de restrições quânticas a uma descrição ondulatória clássica do campo eletromagnético.
A modelagem do comportamento atômico sob radiação eletromagnética incidente utilizando “osciladores virtuais” nas frequências de absorção e emissão, em vez das frequências aparentes (diferentes) das órbitas de Bohr, levou Max Born, Werner Heisenberg e Kramers a explorar diferentes modelos matemáticos. Isso acarretou o desenvolvimento da mecânica matricial, a primeira forma da mecânica quântica moderna. A teoria BKS também provocou a discussão de, e renovou atenção a, dificuldades nas fundações da antiga teoria quântica. O efeito mais controverso da teoria BKS – de que o momento e a energia não seriam necessariamente conservados em cada interação, mas somente de forma estatística – logo se mostrou em conflito com experimentos conduzidos por Walther Bothe e Hans Geiger. À luz desses resultados, Bohr informou Darwin que “não há nada mais a fazer se não dar aos nossos esforços revolucionários um funeral tão honroso quanto possível”.
Bohr dedicou-se também ao estudo do núcleo atómico. O modelo de núcleo em forma de “gota de água” revelou-se muito favorável para a interpretação do fenómeno da fissão do urânio, que abriu caminho para a utilização da energia nuclear. Bohr descobriu que durante a fissão de um átomo de urânio desprendia-se uma enorme quantidade de energia e reparou então que se tratava de uma nova fonte energética de elevadíssimas potencialidades. Bohr, com a finalidade de aproveitar essa energia, foi até Princeton onde se encontrou com Einstein e Fermi para discutir com estes o problema.

Explosão de uma bomba de hidrogênio.
Em 1933, juntamente com seu aluno Wheeler, Bohr aprofundou a teoria da fissão, evidenciando o papel fundamental do urânio 235. Estes estudos permitiram prever também a existência de um novo elemento, descoberto pouco depois: o plutónio.
Em 1934, publicou o livro Atomic Theory and the Description of Nature, que foi reeditado em 1961. Em janeiro de 1937, Bohr participou na Quinta Conferência de Física Teórica, em Washington, na qual defendeu a interpretação de Lise Meitner e Otto Frisch, também do Instituto de Copenhaga, para a fissão do urânio. Segundo esta interpretação, um núcleo atômico de massa instável era como uma gota de água que se rompe.
Três semanas depois, os fundamentos da teoria da “gota líquida” foram publicados na revista Physical Review. A esta publicação seguiram-se muitas outras, todas relacionadas com o núcleo atómico e a disposição e características dos electrões que giram em torno dele.
Um ano depois de se ter refugiado em Inglaterra, devido à ocupação nazi da Dinamarca, Bohr mudou-se para os Estados Unidos, onde ocupou o cargo de consultor do laboratório de energia atómica de Los Alamos. Neste laboratório, alguns cientistas iniciavam a construção da bomba atômica.
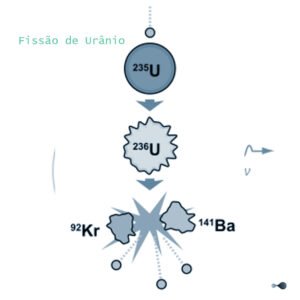
Representação esquemática da fissão do urânio.
Bohr, compreendendo a gravidade da situação e o perigo que essa bomba poderia representar para a humanidade, dirigiu-se a Churchill e Roosevelt, num apelo à sua responsabilidade de chefes de Estado, tentando evitar a construção da bomba atómica.
Mas a tentativa de Bohr foi em vão. Em julho de 1945 a primeira bomba atómica experimental explodiu em Alamogordo. Em Agosto desse mesmo ano, uma bomba atómica destruiu a cidade de Hiroshima. Três dias depois, uma segunda bomba foi lançada em Nagasaki.
Em 1945, finda a II Guerra Mundial, Bohr regressou à Dinamarca, onde foi eleito presidente da Academia de Ciências. Bohr continuou a apoiar as vantagens da colaboração científica entre as nações e para isso foi promotor de congressos científicos organizados periodicamente na Europa e nos Estados Unidos.
Em 1950, Bohr escreveu a “Carta Aberta” às Nações Unidas em defesa da preservação da paz, por ele considerada como condição indispensável para a liberdade de pensamento e de pesquisa.
Em 1957, Niels Bohr recebeu o Prêmio Átomos pela Paz. Ao mesmo tempo, o Instituto de Física Teórica, por ele dirigido desde 1920, afirmou-se como um dos principais centros intelectuais da Europa.
Bohr morreu a 18 de Novembro de 1962, vítima de uma trombose, aos 77 anos de idade. Encontra-se sepultado no Cemitério Assistens, em Copenhaga.
Participou da 5ª, 6ª, 7ª e 8ª Conferência de Solvay.
Após ser laureado com o Nobel de Física de 1922, recebeu de presente da Cervejaria Carlsberg uma casa próximo à cervejaria, que tinha uma torneira com cerveja abastecida diretamente da cervejaria.
CERN
Niels Bohr é um dos pais fundadores do então Conselho Europeu para a Pesquisa Nuclear (CERN), a actual Organização Europeia para a Pesquisa Nuclear, conjuntamente com Pierre Auger, Raoul Dautry, François de Rose e Lew Kowarski pela França e Edoardo Amaldi pela Itália.
O professor Victor Weisskopf do CERN, antigo aluno de Niels Bohr, disse no dia da sua morte que “as bandeiras do CERN estão a meia haste. O CERN perdeu um dos seus fundadores e o mundo perdeu um homem importante”.
Acesso em 15.09 <https://pt.wikipedia.org/wiki/Niels_Bohr> <voltar para biografias>


Uma resposta